 A Rutherford kísérlet az
atommag létezését bizonyítja. A kísérlet alapján felállított modell szerint az
atomban a pozitív töltések nagyon kicsiny térfogatban koncentráltan vannak, s ezek
képviselik az atom tömegének legnagyobb részét.
A Rutherford kísérlet az
atommag létezését bizonyítja. A kísérlet alapján felállított modell szerint az
atomban a pozitív töltések nagyon kicsiny térfogatban koncentráltan vannak, s ezek
képviselik az atom tömegének legnagyobb részét.
A kísérlet felépítése:
Rutherford és tanítványa Mardsen vákuumkamrában radioaktív polónium forrásból származó alfa-részecskékkel bombázott igen vékony fémfóliát (aranyfüstlemezt). Az alábbi animáció mutatja be a kísérletet.
Megjegyzések:
Az alfa-részecskék két egységnyi pozitív elektromos töltésű hélium-ionok (ma már tudjuk, hogy ezek a héliumatom atommagjai).
Vákuumkamrára azért volt szükség, hogy az alfa-részecskék ne szóródjanak szét a levegő molekuláin, ill. az őket alkotó atomokon, s csak a céltárgyként szolgáló aranyfüstlemezzel lépjenek kölcsönhatásba.
Az aranyfüstlemez olyan vékonyra megmunkált aranyfólia, amelyen szinte a fény is át tud haladni. Mivel igen kis mennyiségű (kevés atomrétegnyi) aranyat tartalmaz, a gyakorlati életben díszítésre használják (ilyen aranyfóliákkal "irják" a sírkövek feliratait a temetőkben, de ilyen aranyfóliával burkolják egyes templomok, vagy pl. az Országház egyes termeinek mennyezetét is.)
Milyen ereményt vártak a kísérlettől:
A kísérlet végzése idején az anyag szerkezetére vonatkozóan még a Thomson-féle atommodellt használták. Eszerint az atomok nagy kiterjedésű, pozitív elektromos töltésű, "puha" anyagból, és ezekbe ágyazott apró elektronokból állnak. Az ilyen atom felé nagy sebességgel száguldó nehéz alfa-részecske pályáját a könnyű elektronok biztosan nem tudják módosítani, ezért elegendő csak a nehéz, pozitív töltésű "puding" hatását vizsgálni. Ezért az elektronok hatását teljesen elhanyagoljuk, csak a pudinggal foglalkozunk. Vizsgáljuk azt az esetet, amikor az alfa-részecske éppen "telibe találja" az atomot, azaz egyenesen ütközik vele. Ahogyan közeledik az alfa-részecske az R sugarú pudinghoz, a puding elektromos (Coulomb) taszítás révén fékezi, s ezért az alfa-részecske mozgási energiája lassan csökken, s elektrosztatikus helyzeti energiává alakul. Ha nincs elegendő mozgási energiája, akkor egy idő múlva megáll (ekkor a teljes mozgási energiája helyzeti energiává alakult), majd innen a pozitív töltés taszító hatására visszafordul, és visszarepül. Minél nagyobb volt kezdetben a mozgási energiája, annál mélyebben hatol be az elektromosan töltött "puding" belsejébe. Itt azonban már csak egyre kisebb és kisebb taszítóerőt fog érezni! Ezt beláthatjuk, ha arra gondolunk, hogy a középpontban a ráható erők eredője nyilván nulla kell legyen a szimmetria miatt. Az egyre kisebb és kisebb taszítóerő miatt az elektrosztatikus potenciális energia is lassabban nő, mint a pudingon kívül. Végülis az az elektrosztatikus potenciáldomb, amire az alfa-részecskének fel kell másznia, az ábrán látható módon néz ki.
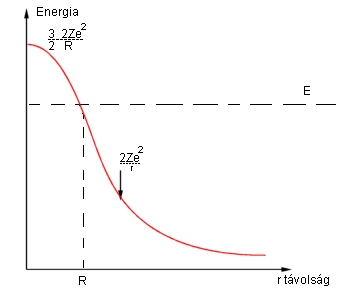
Kölcsönhatási potenciál az alfa-részecske és a Thomson-atom között
A számítások szerint a potenciálgát
maximális magassága másfélszer akkora, mint a részecske potenciális energiája az
"atom" felszínén. Azaz ![]() . Itt e az elemi töltés,
Ze az "atom" teljes töltése, 2e az alfa-részecske
elektromos töltése, R pedig a pozitív töltésű gömb sugara. Az arany
atomjának sugarára is lehet egy becslést adni, s ennek alapján
az aranyatomok sugara
. Itt e az elemi töltés,
Ze az "atom" teljes töltése, 2e az alfa-részecske
elektromos töltése, R pedig a pozitív töltésű gömb sugara. Az arany
atomjának sugarára is lehet egy becslést adni, s ennek alapján
az aranyatomok sugara
R ~ 1,29× 10-10 m. Ezt a képletbe helyettesítve a
maximális energia pedig Emax = 4,23× 10-17J.
Rutherford polónium által kibocsátott alfa-részeket használt, amelyek mozgási energiája 7,64× 10-13J volt, azaz több, mint tízezerszer nagyobb, mint a megmászandó potenciálgát magassága. Ezért Rutherfordék azt várták, hogy az alfa-részecskék úgy áthatolnak az aranyfüst-lemezen, mint a puskagolyó a pudingon.
A kísérlet eredménye:
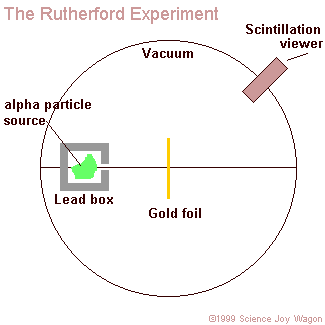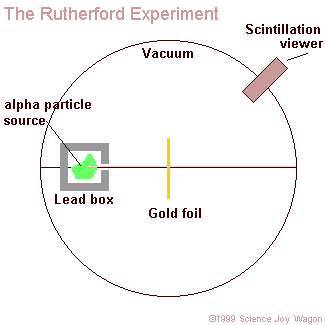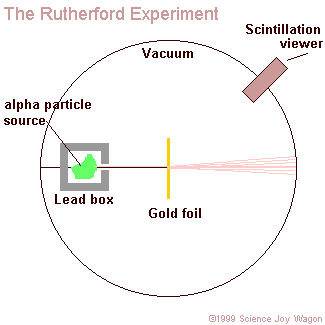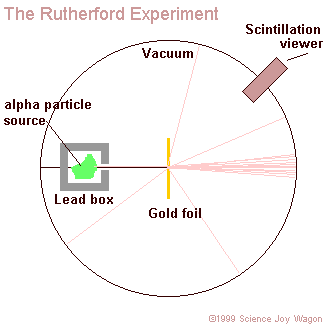
Kezdetben minden az elvárásnak megfelelően történt: az alfa-részecskék valóban áthaladtak a vékony fólián. Egyesek ugyan kissé eltérültek, de arra gondoltak, hogy ezek valószinüleg nem egyenesen ütköztek az atomokkal.
Akkor jött azonban a megdöbbenés, amikor egyszer - szinte véletlenül - a lemez túloldalára is áthelyezték a detektort. Nagyon ritkán ugyan, de azt tapasztalták, hogy voltak olyan alfa-részek, amelyek "visszapattantak" a fóliáról.
Rutherford szerint: "Határozottan ez volt a leghihetetlenebb esemény, amellyel életemben találkoztam. Majdnem olyan hihetetlen volt, mintha valaki 15 hüvelykes gránáttal egy selyempapír darabkára tüzelne, és az visszatérve őt magát találná el."
A kísérlet eredménye a Thomson-féle képpel semmiféleképpen sem volt magyarázható, hiszen a Thomson-atomokon a nagy energiájú alfa-részecskéknek könnyedén át kellett volna hatolniuk, nem pattanhattak volna vissza
A kísérleti tapasztalat értelmezése:
Az, hogy egy alfa-részecske visszafordul, azt
kell jelentse, hogy az alfa-részecske nem tudja megmászni a potenciáldombot, azaz a
mozgási energiája kisebb, mint a potenciálgát magassága. Képletben: ![]() . Ebből átrendezve a
pozitív töltésű gömb sugarára kapunk egy felső korlátot:
. Ebből átrendezve a
pozitív töltésű gömb sugarára kapunk egy felső korlátot: ![]() . Behelyettesítve a számadatokat azt
kapjuk, hogy R<7,15× 10-14 m, azaz több, mint tízezerszer kisebb az
aranyatomok sugaránál!
. Behelyettesítve a számadatokat azt
kapjuk, hogy R<7,15× 10-14 m, azaz több, mint tízezerszer kisebb az
aranyatomok sugaránál!
Rutherford a tapasztaltakból az alábbi következtetéseket vonta le:
- Az atom pozitív
töltése az atom közepén kicsiny térfogatú "magban" helyezkedik el.
- Az atommagban koncentrálódik az atom csaknem teljes tömege.
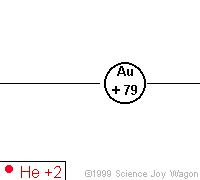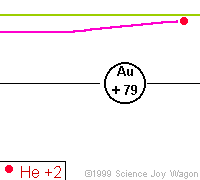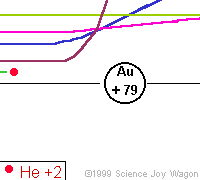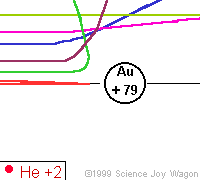
Az alábbi animáció mutatja, hogy hogyan szóródnak a különböző távolságra beeső alfa-részecskék egy atommagon
A Rutherford-féle atommodell:
Az atommag felfedezése után még az elektronokra (és az atom szerkezetére) vonatkozóan is kellett elképzelést kialakítani. Rutherford a Naprendszerhez hasonló modellt állított fel: ahogyan a nagy tömegű Nap körül nagy távolságra keringenek a kis tömegű bolygók, úgy keringenek a nagy tömegű atommag körül a kis tömegű elektronok. Az atomok méretét a Rutherford-modellben tehát az elektronpályák sugara szabja meg ! Mivel az atomok kívülről elektromosan semlegesek, ezért annyi (negatív elektromos töltésű) elektron kering az atommag körül, hogy együttesen kiegyenlítsék az atommagban összezsúfolt pozitív töltéseket.
(ide kellene egy Rutherford-modell animáció:
központi mag körül keringő elektronok... )
Még egy megválaszolandó kérdés:
Ha tehát az alfa-részek az atommagon "visszapattannak", hogyan lehetséges az, hogy a legnagyobb részük mégis áthatolt a fólián? A magyarázat egyszerű: az atommagok "kicsik", de "távol" vannak egymástól, hiszen a Rutherford-féle atommodell szerint a keringő elektronok szabják meg az atom sugarát, és ezzel az atomok egymástól való távolságát is. Ezért az alfa-részek nagy része az atommagok között átsuhan, és csak kis részük talál telibe egy-egy atommagot, és "pattan vissza".
A Rutherford-modell hiányosságai:
A Rutherford-féle atommodell az atommag felismerése révén jelentős előrelépés volt a Thomson-modellhez képest. A Rutherford-modell sajátos ellentmondása, hogy bár az elektromosságtan törvényei alapján "működik", a klasszikus elektromágneses sugárzáselmélettel mégis ellentmondásban van. A keringő elektronok ugyanis gyorsulnak, a gyorsuló töltés pedig elektromágneses sugárzást bocsát ki, s ez a sugárzás energiát visz el. Az energiamegmaradás törvénye értelmében ez a sugárzás a keringő elektron energiáját felemésztené, és az elektron végül belezuhanna az atommagba.
A Rutherford-féle atom tehát a klasszikus fizika törvényei szerint nem lehetne stabil.
Dr.Jarosievitz Beáta & Dr.Sükösd Csaba