|
Fogalomtár Aktivitás Egy anyag aktivitásán az időegység alatt bekövetkező bomlások számát értjük. (Az időegységet a felezési időnél sokkal rövidebbnek kell választani!) Az aktivitás mértékegysége a becquerel (ejtsd: bekerel).
1 Bq = 1 bomlás/s. Egy anyag aktivitása egyenesen arányos a benne lévő atommagok N számával, valamint a 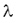 bomlásállandóval. bomlásállandóval. 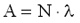
Mivel egy radioaktív anyagban az el nem bomlott atommagok N száma – a felezési idő által megszabott módon - csökken, ezért az anyag aktivitása is ugyanilyen ütemben csökken. Alfa-bomlás Alfa-bomláskor egy hélium-ion (alfa részecske, 4He) bocsátódik ki, ezért a tömegszám néggyel, a rendszám kettővel csökken. 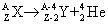
A könnyű atommagoknál a tömegszám csökkentése nem energianyereséges, ezért alfa-bomlókat csak a nehezebb atommagok között találunk. Béta-bomlások A béta-bomlásoknak három típusa van:
- negatív
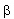 -bomlás, -bomlás, - pozitív
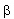 -bomlás, -bomlás, - elektronbefogás.
Ezek közül itt most csak a radioaktív bomlási sorokban előforduló negatív 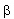 -bomlással foglalkozunk részletesebben. -bomlással foglalkozunk részletesebben. Negatív béta-bomlás A negatív 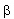 -bomlás során lényegében az atommag egy neutronja protonná alakul, miközben egy elektron (e-) lép ki. (A bomlás során keletkezik még egy parányi semleges részecske – egy antineutrínó – is, de ezt gyakorlati szempontból elhanyagolhatjuk, mert az anyaggal alig lép kölcsönhatásba.) -bomlás során lényegében az atommag egy neutronja protonná alakul, miközben egy elektron (e-) lép ki. (A bomlás során keletkezik még egy parányi semleges részecske – egy antineutrínó – is, de ezt gyakorlati szempontból elhanyagolhatjuk, mert az anyaggal alig lép kölcsönhatásba.) A negatív 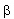 -bomlás egyenlete: -bomlás egyenlete: 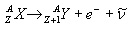
A negatív 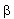 -bomlás során tehát az atommag rendszáma eggyel nő, tömegszáma változatlan marad. -bomlás során tehát az atommag rendszáma eggyel nő, tömegszáma változatlan marad. Bomlásállandó A radioaktív anyagok bomlása véletlenszerű. Annak a valószínűségét, hogy egy kiszemelt atommag időegység (pl. egy másodperc) alatt elbomlik, bomlásállandónak nevezzük.
A bomlásállandó jele: 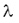
Mértékegysége: 1/s. Kis értékű bomlásállandó lassú bomlást, nagy értékű bomlásállandó gyors bomlást jelez. A bomlásállandó segítségével egy adott anyag aktivitása is meghatározható: 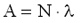
Itt A az anyag aktivitása (időegységre eső bomlások száma), N pedig az anyagban lévő, bomlásra képes atommagok száma. A bomlásállandó a felezési idővel is kapcsolatban van: 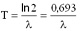
Itt T az anyag felezési ideje. Felezési idő Azt az időt, amely alatt egy radioaktív anyagban a radioaktív magok száma a kezdeti érték felére csökken, felezési időnek nevezzük. Az atommagok várható N(t) száma az idő (t) függvényében a következő matematikai képlettel számítható ki: 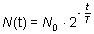
Itt t az eltelt idő, N0 a radioaktív atommagok kezdeti (t =0) száma, T pedig a felezési idő. Ez a függvény látható az alábbi ábrán. 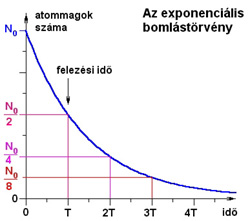
A felezési idő és a bomlásállandó egymással fordított arányban állnak: minél kisebb a bomlási állandó, annál hosszabb idő kell ahhoz, hogy az anyag fele elbomoljon. A pontos összefüggés a következő: 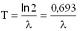
Itt T a felezési idő, 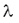 pedig a bomlásállandó. pedig a bomlásállandó. A felezési idő jellemző az adott izotópra. A különböző radioaktív anyagok felezési ideje a tízmilliárd évtől a másodperc milliárdod részéig terjedhet. Annak a valószínűsége, hogy egy kiszemelt atommag T1/2 idő alatt elbomlik (T1/2 a felezési idő) éppen 1/2. Újabb T1/2 idő alatt bekövetkező bomlás valószínűsége ismét 1/2, attól függetlenül, hogy az atommag mióta "vár" már a bomlásra. Gamma-bomlás A 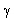 -bomlás hasonlít az atomok fénykibocsátáshoz, hiszen ennek során az atommag elektromágneses sugárzást (ún. -bomlás hasonlít az atomok fénykibocsátáshoz, hiszen ennek során az atommag elektromágneses sugárzást (ún. 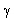 -fotonokat) bocsát ki. -fotonokat) bocsát ki. A fénykibocsátáshoz képest egyrészt az a különbség, hogy a gamma fotonok az atommagból lépnek ki míg a fénykibocsátás az atommagot körülvevő elektronhéjból származik, másrészt pedig a 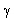 -bomlás során általában több nagyságrenddel nagyobb energia szabadul fel, mint látható fény kibocsátásakor. A gamma-sugárzás nagyon kis hullámhosszúságú elektromágneses sugárzás, ezért sem elektromos, sem mágneses mezővel nem lehet eltéríteni. Általában az alfa- és béta-bomlást követően észlelhető. -bomlás során általában több nagyságrenddel nagyobb energia szabadul fel, mint látható fény kibocsátásakor. A gamma-sugárzás nagyon kis hullámhosszúságú elektromágneses sugárzás, ezért sem elektromos, sem mágneses mezővel nem lehet eltéríteni. Általában az alfa- és béta-bomlást követően észlelhető. Izobár Az izobárok olyan atommagok, amelyek tömegszáma megegyezik, de amelyek rendszáma eltér. Az izobár atommagok egymásba béta-bomlásokkal alakulhatnak át. Izotóp Az izotópok olyan atommagok, amelyek rendszáma megegyezik, de tömegszáma eltér. Az izotóp atommagok kémiai, biológiai, stb. viselkedése teljesen megegyezik, bár magfizikai szempontból különböző részecskék. Erre Hevesy György (1885. 08. 01. Budapest-1966. 07. 05. Freiburg – kémiai Nobel díj 1944) jött rá, és használta fel az izotópos nyomjelzés során. 
Neutron Latinul neutralis azt jelenti, hogy semleges. Elektromosan semleges elemi részecske. Jelölése: n. A protonnal együtt minden atommagban megtalálható (kivétel a hidrogén legkönnyebb izotópja). A neutront és a protont közös névvel nukleonnak nevezzük. Tömege: 1,674920* 10-27 kg = (1,00866497±0,0000004) u. Proton Görögül annyit tesz: első. A proton a hidrogén legkönnyebb izotópjának atommagja, stabil elemi részecske. Tömege: 1,672614* 10-27 kg = (1,007264433 ± 0,0000008) u, Töltése: 1,6021917* 10-19 C (egyszeres pozitív elemi töltés). Tömegszám Az atommagot protonok és neutronok alkotják. Ezeket közös névvel nukleonoknak nevezzük. A protonok száma, amelyet szokásosan Z-vel jelölünk, az elem rendszáma. (Ez megegyezik az atom helyével a Periódusos Rendszerben). A protonok és a neutronok számának az összegét az atommag tömegszámának nevezzük, és A-val jelöljük. A = Z + N A tömegszámot az atom vegyjele elé, balra felülre írjuk. Például a 238 tömegszámú urán atommag jele: 238U. Néha kiírják az atommag rendszámát is, bár ezt az elem vegyjele már meghatározza: 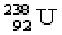
|








